P02
Role of sphingolipids in the regulation of anti-viral T cell responses
Jürgen Schneider-Schaulies and Niklas Beyersdorf
Institute for Virology and Immunobiology, University of Würzburg, Versbacher Str. 7, 97078 Würzburg, Germany
Overview (in German)
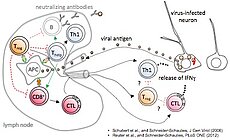
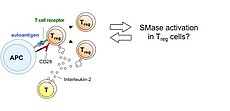
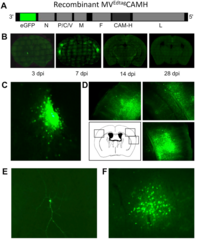
Der Sphingolipidmetabolismus kann virale Infektionen und Immunantworten auf vielen Ebenen beeinflussen. In unserem Masernvirus (MV)-Infektionsmodell des zentralen Nervensystems (ZNS) beobachteten wir bereits die Folgen der sauren Sphingomyelinase (Asm)-Defizienz in Mäusen, nämlich eine verminderte Widerstandsfähigkeit gegenüber viraler Infektion, und entdeckten, dass sowohl genetische Defizienz, als auch pharmakologische Hemmung der Asm die Aktivität CD4+ Foxp3+ regulatorischer T-Zellen (Treg) erhöht (Hollmann et al., J. Immunol, 2016, 197:3130-3141). Nun wollen wir herausfinden, wie assoziierte Reaktionswege und Enzyme, für die teilweise Inhibitoren schon in klinischem Gebrauch sind, genutzt werden können, um den gegenteiligen Effekt zu erreichen, d.h. die antivirale Immunreaktion zu stärken. Vorläufige Daten weisen darauf hin, dass die MV-Infektion durch Inhibition der sauren Ceramidase (Acd) oder der Sphingosin-Kinase-1 gehemmt wird. In der kommenden Förderperiode haben wir deshalb zwei Hauptziele: (1.) In einem genetischen Ansatz charakterisieren wir mithilfe neuartiger Mausmodelle die Folgen induzierter Gendefizienz der Acd, der neutralen Sphingomyelinase (Nsm) und auch der Asm, um ihre Rolle in bestimmten Zelltypen zu analysieren und dann gezielt die T-Zell-vermittelte Immunantwort zu manipulieren, um schließlich eine Stärkung der antiviralen Immunantwort zu erreichen. Dabei werden wir induzierbare Gen-Knockouts in spezifischen Zelltypen in der Maus untersuchen. (2.) In einem Inhibitor-Ansatz wollen wir die Effekte pharmakologischer Inhibitoren der am Sphingolipid-Metabolismus beteiligten Enzyme untersuchen, um Bedingungen zu definieren, unter denen T-Zell-vermittelte Immunität und Viruseliminierung gestärkt werden. Dies wird in Zellkulturen humaner und muriner Lymphozyten und in vivo im Mausmodell durchgeführt werden.
Overview (in English)
The sphingolipid metabolism influences viral infections and the immune response on multiple levels. Using our measles virus (MV) infection model of the central nervous system (CNS) we have already observed consequences of acid sphingomyelinase (Asm)-deficiency in mice, namely a reduction of resistance to the viral infection, and revealed that either genetic ablation or pharmacologic inhibition of Asm increases the activity of CD4+ Foxp3+ regulatory T cells (Hollmann et al., J. Immunol, 2016, 197:3130-3141). Now we want to find out how associated pathways and enzymes, for some of which inhibitors are already in clinical use, can be exploited to achieve the contrary effect, namely to improve anti-viral immunity. Our preliminary data indicate that MV infection is reduced by inhibition of acid ceramidase (Acd) or sphingosine kinase-1. In the upcoming funding period we, therefore, have two major aims: (1.) In a genetic approach we will characterize the effects of induced gene deficiencies of the Acd, the neutral sphingomyelinase (Nsm) and also the Asm in order to analyze their role in defined cell types and to then selectively manipulate T cell-mediated immune responses, to finally improve resistance to viral infection. Here we will investigate inducible gene knockouts in specific cell types in mice. (2.) In an inhibitor approach we will evaluate effects of pharmacological inhibitors of sphingolipid-metabolizing enzymes in order to define conditions to increase T cell-mediated immunity and viral clearance. This is being done in human and mouse lymphocyte cultures in vitro, and in vivo in the mouse model.